Общая химия
Методичка по химии — общая и неорганическая.
Методичка Химия
Методичка 450 заданий
Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РН3, Н20, НВг.
В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН? Ответ: 100 г.
Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалентную массу этого металла. Ответ: 32, 5 г/моль.
Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла. Ответ: 9 г/моль.
Оксид трех валентного элемента содержит 31,58% кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента.
Чему равен при н.у. эквивалентный объем водорода? Вычислите эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Ответ: 32, 68 г/моль.
В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса этого металла?
Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите эквивалентную массу, мольную массу и атомную массу этого металла.
Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите эквивалентную массу этого металла. Ответ: 103,6 г/моль.
Напишите уравнения реакций Fe(0H)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: хлорид дигидроксо железа; дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и эквивалентную массу Fe(OH)3 в каждой из этих реакций.
Избытком гидроксида калия подействовали на растворы: дигидрофосфата калин; нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы.
Избытком хлороводородной (соляной) кислоты подействовали на растворы:
гидрокарбоната кальция; дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCI и определите их эквиваленты и эквивалентные массы.
При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите эквивалентную, мольную и атомную массы металла.
На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NaOH. Вычислите эквивалент, эквивалентную массу и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции. Ответ: 0,5 моль, 49 г/моль
На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты. На основании расчета напишите уравнение реакции. Ответ: 0,5 моль, 41 г/моль, 2.
Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 2 Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
Напишите электронные формулы атомов элементов с порядковыми номерами 25 и К какому электронному семейству относится каждый из этих элементов?
Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4р? Почему? Напишите электронную формулу атома элемента с порядковым номером
Изотоп никеля-57 образуется при бомбардировке tt-частицами ядер атомов железа-
Изотоп углерода-11 образуется при бомбардировке протонами ядер атомов азота-14. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Исходя из положения германия и технеция в периодической системе, составьте формулы мета-, ортогерманиевой кислот и оксида технеция, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и p-элементов в группах периодической системы с увеличением порядкового номера? Почему?
Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. ,
Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод CS2 (г)., Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: +65,43 кДж.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
При получении эквивалентной массы гидроксида кальция из СаО (к) и Н20 (ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и
Вычислите молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция плотностью 1,178 г/см3. Ответ: 2,1 М; 4,2 н.
Чему равна нормальность 30%-ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора. Ответ: 9,96 н.; 6,3%.
Вычислите молярную, эквивалентную и моляльную концентрации 16%-ного раствора хлорида алюминия плотностью 1,149 г/см3. Ответ: 1,38 М; 4,14 н.; 1,43 м.
Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна процентная концентрация охлажденного раствора? Ответ: 16,7%.
Сколько граммов фенола С5Н5ОН следует растворить в 125 г бензола; чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7 ? Криоскопическая константа бензола 5,1 . Ответ: 3,91 г.
Составьте молекулярные и ионно-молекулярные уравнения реакции взаимодействия в растворах между: а) КНС03 и H2S04; б) Zn(OH)2 и NaOH; в) СаС12 и AgN03.
Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов K2S и СгС13. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты.
Исходя из степени окисления фосфора в соединениях РН3, НзР04, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
PbS + HNO3 ->S + Pb(N03)2 + NO + H20
Составьте схемы двух гальванических элементов, в одном из которых медь была бы
катодом, а в другом — анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
При какой концентрации ионов Си2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 1,89-10 12 моль/л.
Электролиз раствора K2SO4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 5,03 г; 6,266 л; 3,133 л.
Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [ Cu(NH3) 43SO4, K2[PtCI6], K[Ag(CN)2j. Напишите уравнения диссоциации этих соединений в водных растворах.
Какую степень окисления может проявлять водород в своих соединениях? Приведите примеры реакций, в которых газообразный водород играет роль окислителя и в которых — восстановителя.
Составьте электронные и молекулярные уравнения реакций: кальция с водой; магния с азотной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция? Ответ: 6,5 мэкв/л.
Как проявляет себя сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия раствора сероводорода: с хлором; с кислородом.
К раствору, содержащему SbCI3 и BiCI3, добавили избыток раствора гидроксида калия. Напишите молекулярные и ионно-молекулярные уравнения происходящих реакций. Какое вещество находится в осадке?
При сливании растворов нитрата серебра и цианида калия выпадает осадок, который легко растворяется в избытке KCN. Какое комплексное соединение при этом получается? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
Хром получают методом алюминотермии из его оксида (III), а вольфрам — восстановлением оксида вольфрама (VI) водородом. Составьте электронные и молекулярные уравнения соответствующих реакций.
Полимером какого непредельного углеводорода является натуральный каучук? Напишите структурную формулу этого углеводорода. Как называют процесс превращения каучука в резину? Чем по строению и свойствам различаются каучук и резина?
Какие полимеры называются термопластичными, термореактивными? Укажите три состояния полимеров. Чем характеризуется переход из одного состояния в другое?
Контрольні роботи і задачі з хімії
Отображение 1–32 из 386
-
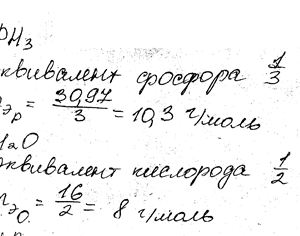
Химия задача 1
Описание
Определите эквивалент и эквивалентную массу фосфора, кислорода и Брома в соединениях РН3, Н2О, НВr.
Методичка здесь
методичка химия 2013Методичка на украинском языке
1.00 $ В корзину
метод усл -

Химия задача 10
Описание
Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла нужно 0,69 л кислорода (н.у.). Вычислите эквивалентную, мольную и атомную массы этого металла.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 101
Описание
Вычислите молярную и эквивалентную концентрации 20% -ного раствора хлорида кальция плотностью 1,178 г / см3.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
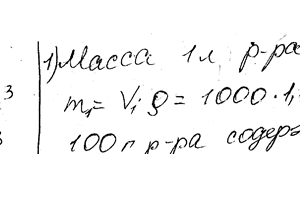
Химия задача 102
Описание
Чему равна нормальность 30% -ного раствора NaOH плотностью 1,328 г/см3? До 1 л этого раствора добавили 5 л воды. Вычислите процентную концентрацию полученного раствора.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
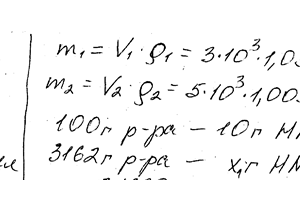
Химия задача 103
Описание
К 3 л 10% -ного раствора НNОз плотностью 1,054 г / см3 добавили 5 л 2% -ного раствора той же кислоты плотностью 1,009 г / см. Вычислите процентную и молярную концентрацию полученного раствора, объем которой равен 8 л.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
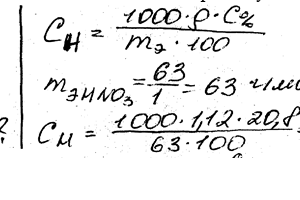
Химия задача 104
Описание
Вычислить эквивалентную и моляльную концентрации 20,8% -ного раствора НNO3 плотностью 1,12 г / см3. Сколько граммов кислоты содержится в 4 л этого раствора?
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
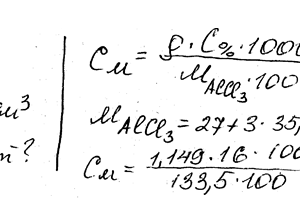
Химия задача 105
Описание
Вычислите молярную, эквивалентную и моляльную концентрации 16% -ного раствора алюминий хлорида плотностью 1,149 г / см3.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 106
Описание
Сколько вещества останется в избытке, если до 75 см3 0,3 н раствора Н2SO4 добавить 125 см3 0,2 н. раствора КОН?
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 107
Описание
Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3, надо было 50 см3 0,2 н. раствора НСl. Какая нормальность раствора АgNOз? Какая масса AgCl выпала в осадок?
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
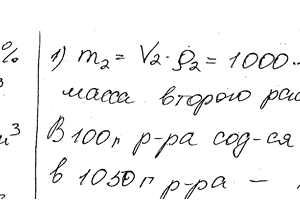
Химия задача 108
Описание
Какой объем 20,01% -ного раствора HCl (плотн. 1,100 г / см3) требуется для приготовления 1 л 10,17% -ного раствора (плотн. 1,050 г / см3)?
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
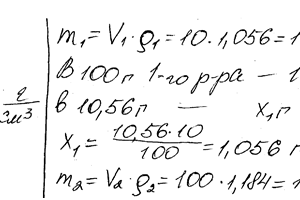
Химия задача 109
Описание
Перемешаны 10 см3 10% -ного раствора НNО3 (плотн. 1,056 г / см3) и 100 см3 30% — ного раствора НNО3 (плотн. 1184 г / см3). Вычислите процентную концентрацию полученного раствора.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
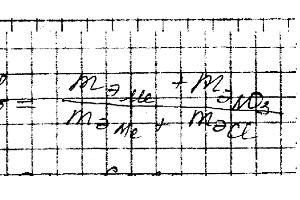
Химия задача 11
Описание
С 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите эквивалентную массу этого металла.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
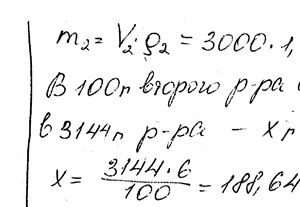
Химия задача 110
Описание
Какой объем 50% -ного раствора КОН (плотн. 1,538) требуется для приготовления 3 л 6% -ного раствора (плотн. 1,048 г / см3)?
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
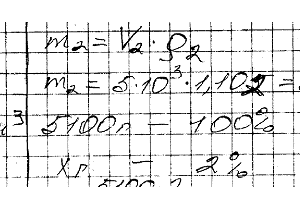
Химия задача 111
Описание
Какой объем 10% -ного раствора натрия карбоната (плотн. 1,105 г / см3) требуется для приготовления 5 л 2% -ного раствора (плотн. 1,02 г/ см3)?
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 122
Описание
Вычислить процентную концентрацию водного раствора сахара С12Н22О10, зная, что температура кристаллизации раствора -0,93 ° С. Криоскопическая константа воды 1,86 °.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
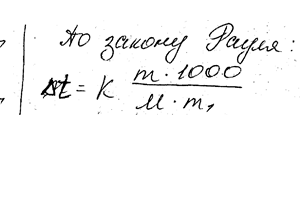
Химия задача 123
Описание
Вычислить температуру кристаллизации раствора мочевины (NH2) 2CO, содержащий 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 124
Описание
Раствор 3,04 г камфоры C10H16O в 100 г бензола кипит при 80,714 ° С. Температура кипения бензола 80,2 ° С. Вычислите эбулиоскопическую константу бензола.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 125
Описание
Вычислить процентную концентрацию водного раствора глицерина С3Н5 (ОН) 3, если известно, что этот раствор кипит при 100,39 ° С. Эбулиоскопическая константа воды 0,52 °.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
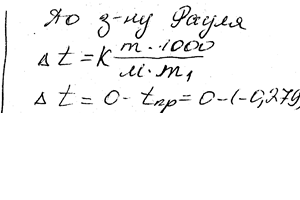
Химия задача 126
Описание
Вычислить мольную массу неэлектролита, если раствор содержит 2,25 г этого вещества в 250 г воды и кристаллизуется при -0,279 ° С. Криоскопическая константа воды 1,86 °.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
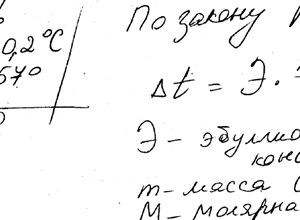
Химия задача 127
Описание
Вычислить температуру кипения 5% -ного раствора нафталина C10H8 в бензоле. Температура кипения бензола 80,2 ° С. Эбулиоскопическая константа бензола 2,57 °.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 128
Описание
Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0,465 ° С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86 °.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 129
Описание
Вычислить криоскопическую константу уксусной кислоты, если раствор содержит 4,25 г антрацена C14H10 в 100 г уксусной кислоты и кристаллизуется при 15,718 ° С. Температура кристаллизации уксусной кислоты 16,65 ° С.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
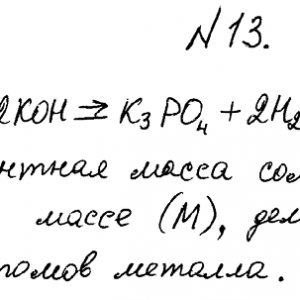
Химия задача 13
Описание
Избытком калий гидроксида подействовали на растворы:
а) калий фосфат; б) дигидроксобисмут (III) нитрата. Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы.Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 130
Описание
При растворении 4,86 г серы в 60 г бензола температура его кипения повысилась на 0,81 °. Сколько атомов содержит молекула серы в этом растворе. Эбулиоскопическая константа бензола 2,57 °.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
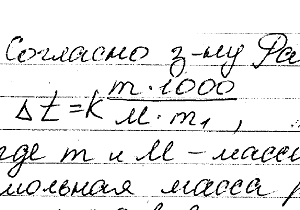
Химия задача 132
Описание
Какую массу анилина C6H5NH2 стоит растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53°. Эбулиоскопическая константа этилового эфира 2,12°.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 133
Описание
Вычислить температуру кристаллизации 2% -ного раствора этилового спирта C2H5OH. Криоскопическая константа воды 1,86.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 134
Описание
Сколько граммов мочевины (NH2) 2CO стоит растворить в 75 г воды, чтобы температура кристаллизации снизилась на 0,465°? Криоскопическая константа воды 1,86 °.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -
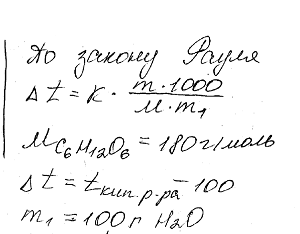
Химия задача 135
Описание
Вычислить процентную концентрацию водного раствора глюкозы C6H12O6, если этот раствор кипит при 100,26°С. Эбулиоскопическая константа воды 0,52 °.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 137
Описание
Сколько граммов мочевины (NH2) 2CO стоит растворить в 250 мл воды, чтобы температура кипения повысилась на 0,26° ? Эбулиоскопическая константа воды 0,52 °.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 138
Описание
При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации снижается на 0,372 °. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86 °.
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл -

Химия задача 139
Описание
Вычислить температуру кипения 15% -ного водного раствора пропилового спирта С3Н7ОН. Эбулиоскопическая константа воды 0,52 °.
1.00 $ В корзину
Методичка здесь
методичка химия 2013
Методичка на украинском языке
метод усл -
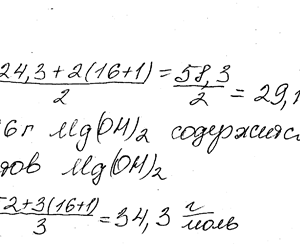
Химия задача 14
Описание
В каком количестве Сг(ОН)3 содержится столько же эквивалентов, сколько в 174,96 г Мg (ОН) 2?
Методичка здесь
1.00 $ В корзину
методичка химия 2013
Методичка на украинском языке
метод усл